Korrosion in metallischen Leitungsnetzen
Hintergrund:
Die SWKI-Richtlinien schreiben für sämtliche
Heizungsanlagen enthärtetes und vollentsalztes Wasser vor:
Gesamthärte < 1 °fH
Leitfähigkeit < 100 µS
pH-Wert 6.0 – 8,5 pH
Grundsätzlich ist die Idee gut.
Bei genauerer Betrachtung
der Korrosions-Systeme, wird jedoch klar, dass die Richtlinie lediglich
Symtome bekämpft nicht Ursachen. Zudem entstehen andere Probleme;
- MID-Durchflussmesser funktionieren nicht
- Kalk für die
Pufferung des pH-Wertes fehlt => Wasserstoffkorrosion
- Eisensalze,
eine Verbindung von Eisen mit Nichtmetallen erhöhen die Leitfähigkeit
sofort
Als Folge müssen Anlagen
regelmässig geprüft und nachjustiert werden
Ursache:
Wie die meisten Stoffe versucht auch Eisen wieder seine
Ursprungsform zu erlangen, also;
- Magnetit bzw. Magneteisenstein:
Fe3O4
- Hämatit bzw. Eisenglanz: Fe2O3
Eisen (Fe), der Hauptbestandteil unserer Rohre aus C-Stahl
hat also das unbezwingbare Bedürfnis sich mit Sauerstoff (O)
zu verbinden.
Kupfer zB. liegt als Kupferglanz
(Cu2S) oder Kupferkies (CuFeS2) vor, weshalb es viel weniger mit O2
reagiert
ebenso liegen die meisten Kunststoffe (C3H6)
in reiner Form vor.
Lösung:
Drei Lösungsansätze sind schlussendlich erfolgsversprechend:
1. Anlagen aus edlen Metallen erstellen
(zB. Cu-Kühldecken nur mit Edelstahlrohren
erschliessen)
2. Anlagen aus unedlen Metallen erstellen
(zB. Heizkörper nur mit Stahlrohren erschliessen)
3. Anlagen aus Kunststoff erstellen
(zB. Kühlsysteme,
FBH, Trinkwasser etc. jedoch mit "edelen" Armaturen)
DIE MISCHUNG VON METALLEN ZERSTÖRT DURCH ELEKTROLYSE UND GALVANIK IN JEDEM FALL DAS UNEDLERE
Langzeit-
Prüfung
für eine
Anlage
mit gemischten Metall-
werkstoffen
Kupfer - Aluminium
- Edelstahl - Messing - Stahl schwarz - Stahl erzinkt - Grauguss
I = Spannung grösser 1 [V], 00.0 = nicht angeschlossen, xx.x = Spannung in [mV]
Auf's Bild klicken, einloggen und live erleben was in einer Anlage geschieht (Weiterleitung auf Hubble, Geduld dauert etwas mit Starten)
Username: bauda
Password: abcd1234
Korrosionsarten
Sauerstoff-
Korrosion
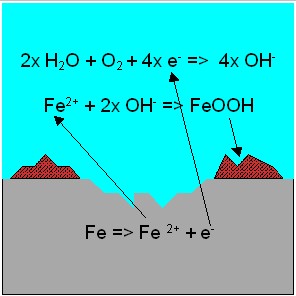
Als Sauerstoffkorrosion
bezeichnet man einen Korrosionsvorgang, bei dem ein Metall
in Gegenwart von Wasser durch Sauerstoff oxidiert wird.
Bei der Sauerstoffkorrosion reagieren
die im Elektrolyt (Wasser) gelösten Sauerstoff-
moleküle
mit Wasser zu Hydroxid-Ionen, die dann mit dem Metall Oxide und
Hydroxide
bilden können, sprich Rost
Häufig anzutreffen
ist diese Reaktion in Rohrnetzen aus Stahl
Wasserstoff- bzw. Säurekorrosion
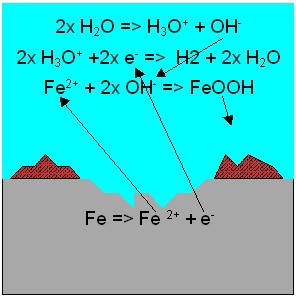
Wasserstoffkorrosion
ist eine Form der Korrosion bei Metallen, die in Anwesenheit
von saurem Wasser, jedoch unter Sauerstoffmangel, zur Bildung von
elementarem
Wasserstoff führt.
Das Metall wird oxidiert und geht
als Ionen in Lösung. Im sauren Milieu werden die
Protonen
der Oxonium-Ionen durch Aufnahme von Elektronen zu Wasserstoff reduziert
und Wasser entsteht.
Häufig anzutreffen ist diese
Reaktion in Rohrnetzen aus Stahl
Elektrochemische Korrosion
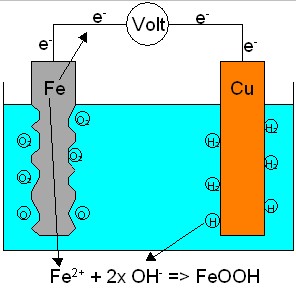
Galvanische
Korrosion entsteht dann, wenn unterschiedliche Metalle direkt oder
über
ein Elektrolyt (Wasser) verbunden Das Metall mit
dem höheren elektrischen Potential
wird zur Anode, und
das mit dem niedrigeren zur Kathode.
Es fliesst Strom von der Anode (unedeles
Metall) zur Kathode (edles Metall).
Die Anode löst sich
auf oder korrodiert. Durch den Gleichstrom wird Wasser
in Sauerstoff
und Wasserstoff zerlegt.
Wodurch wiederum die Wasserstoff
und Sauerstoffkorrosion beginnen!
DESHALB KEINE MISCHUNG
DER METALLE
